Ideālās gāzes īpašību izpēte ir svarīgs fizikas temats. Ievads gāzes sistēmu raksturlielumos sākas ar Boila-Mariota vienādojuma apsvēršanu, jo tas ir pirmais eksperimentāli atklātais ideālās gāzes likums. Apskatīsim to sīkāk rakstā.
Ko nozīmē ideāla gāze?
Pirms runāt par Boila-Mariota likumu un to aprakstošo vienādojumu, definēsim ideālu gāzi. To parasti saprot kā šķidru vielu, kurā daļiņas, kas to veido, savstarpēji mijiedarbojas, un to izmēri ir nenozīmīgi mazi, salīdzinot ar vidējiem attālumiem starp daļiņām.
Patiesībā jebkura gāze ir īsta, tas ir, tās atomiem un molekulām ir noteikts izmērs un tās savstarpēji mijiedarbojas ar van der Vālsa spēku palīdzību. Tomēr augstā absolūtā temperatūrā (vairāk nekā 300 K) un zemā spiedienā (mazāk par vienu atmosfēru) atomu un molekulu kinētiskā enerģija ir daudz augstāka nekā van der Vāla mijiedarbības enerģija, tāpēc reālā gāze norādītajāapstākļus ar augstu precizitāti var uzskatīt par ideāliem.
Boila-Mariotas vienādojums
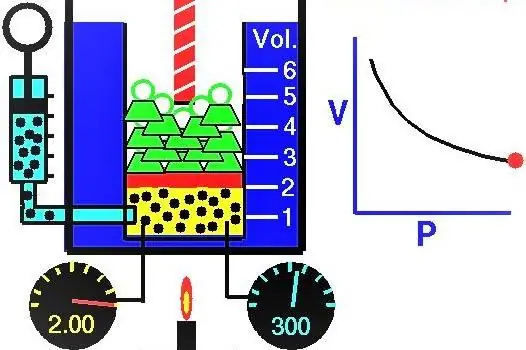
Gāzu īpašības Eiropas zinātnieki aktīvi pētīja XVII-XIX gadsimtā. Pats pirmais gāzes likums, kas tika atklāts eksperimentāli, bija likums, kas apraksta gāzes sistēmas izotermiskos izplešanās un saspiešanas procesus. Atbilstošus eksperimentus veica Roberts Boils 1662. gadā un Edms Mariote 1676. gadā. Katrs no šiem zinātniekiem neatkarīgi parādīja, ka izotermiska procesa laikā slēgtā gāzes sistēmā spiediens mainās apgriezti tilpumam. Eksperimentāli iegūtā procesa matemātiskā izteiksme ir uzrakstīta šādā formā:
PV=k
Kur P un V ir spiediens sistēmā un tās tilpums, k ir kāda konstante, kuras vērtība ir atkarīga no gāzes vielas daudzuma un tās temperatūras. Ja jūs veidojat P(V) funkcijas atkarību no grafa, tad tā būs hiperbola. Šo līkņu piemērs ir parādīts zemāk.
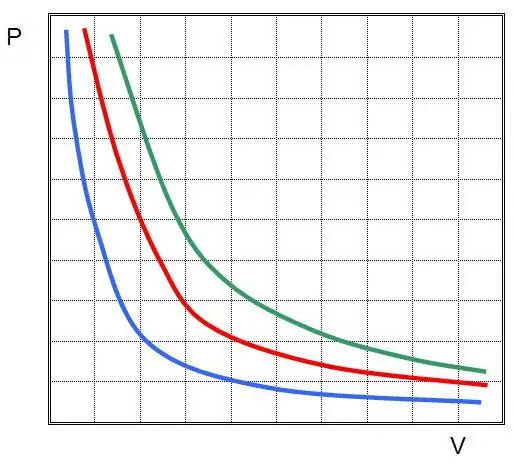
Rakstīto vienlīdzību sauc par Boila-Mariotes vienādojumu (likumu). Šo likumu īsumā var formulēt šādi: ideālas gāzes izplešanās nemainīgā temperatūrā izraisa proporcionālu spiediena samazināšanos tajā, gluži pretēji, gāzes sistēmas izotermisku saspiešanu pavada proporcionāls spiediena pieaugums tajā.
Ideāls gāzes vienādojums
Boila-Mariotas likums ir īpašs gadījums vispārīgākam likumam, kurā ir Mendeļejeva unKlepeirons. Emīls Klepeirons, apkopojot eksperimentālo informāciju par gāzu uzvedību dažādos ārējos apstākļos, 1834. gadā ieguva šādu vienādojumu:
PV=nRT
Citiem vārdiem sakot, gāzes sistēmas tilpuma V un tajā esošā spiediena P reizinājums ir tieši proporcionāls absolūtās temperatūras T un vielas daudzuma n reizinājumam. Šīs proporcionalitātes koeficientu apzīmē ar burtu R un sauc par gāzes universālo konstanti. Rakstītajā vienādojumā R vērtība parādījās vairāku konstantu aizstāšanas dēļ, ko veica Dmitrijs Ivanovičs Mendeļejevs 1874. gadā.
No universālā stāvokļa vienādojuma var viegli saprast, ka temperatūras un vielas daudzuma noturība garantē vienādojuma labās puses nemainīgumu, kas nozīmē, ka vienādojuma kreisā puse arī paliks nemainīga. Šajā gadījumā mēs iegūstam Boila-Mariota vienādojumu.

Citi gāzes likumi
Iepriekšējā rindkopā uzrakstītais Klepeirona-Mendeļejeva vienādojums satur trīs termodinamiskos parametrus: P, V un T. Ja katrs no tiem ir fiksēts un pārējie divi ir atļauti mainīties, mēs iegūstam Boila-Mariota vienādojumu, Čārlza un Geja-Lusaka vienādojumi. Čārlza likums runā par tiešu proporcionalitāti starp tilpumu un temperatūru izobāriskajam procesam, un Gay-Lussac likums nosaka, ka izohoriskas pārejas gadījumā gāzes spiediens palielinās vai samazinās tieši proporcionāli absolūtajai temperatūrai. Atbilstošie vienādojumi izskatās šādi:
V/T=const, kad P=const;
P/T=const, kad V=const.
TātadTādējādi Boila-Mariotas likums ir viens no trim galvenajiem gāzes likumiem. Tomēr tā atšķiras no pārējām grafiskās atkarības ziņā: funkcijas V(T) un P(T) ir taisnas līnijas, funkcija P(V) ir hiperbola.
Uzdevuma piemērs Boila-Mariota likuma piemērošanai
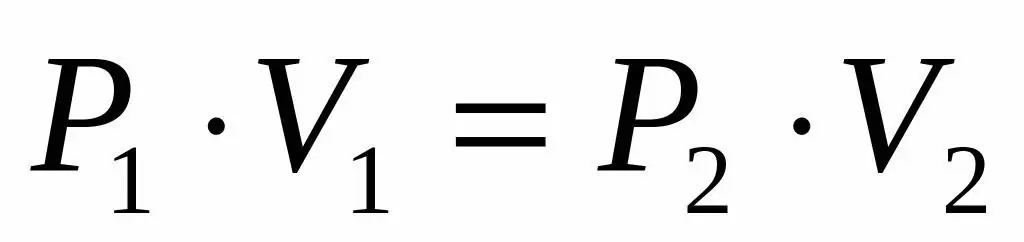
Gāzes tilpums cilindrā zem virzuļa sākotnējā stāvoklī bija 2 litri, un tās spiediens bija 1 atmosfēra. Kāds bija gāzes spiediens pēc virzuļa celšanās un gāzes sistēmas tilpuma palielināšanās par 0,5 litriem. Process tiek uzskatīts par izotermisku.
Tā kā mums ir dots ideālās gāzes spiediens un tilpums, kā arī mēs zinām, ka temperatūra tās izplešanās laikā nemainās, mēs varam izmantot Boila-Mariota vienādojumu šādā formā:
P1V1=P2V 2
Šī vienādība saka, ka tilpuma-spiediena reizinājums ir nemainīgs katram gāzes stāvoklim noteiktā temperatūrā. Izsakot vērtību P2 no vienādības, iegūstam galīgo formulu:
P2=P1V1/V 2
Veicot spiediena aprēķinus, šajā gadījumā var izmantot ārpussistēmas mērvienības, jo litri saruks, un mēs iegūstam spiedienu P2atmosfērās. Aizvietojot datus no nosacījuma, mēs nonākam pie atbildes uz problēmas jautājumu: P2=0,8 atmosfēras.






