Mūsu laikā fizika ir kļuvusi par ļoti izplatītu zinātni. Tas ir burtiski visur. Pats elementārākais piemērs: tavā pagalmā aug ābele, uz kuras nogatavojas augļi, pienāk laiks un sāk birt āboli, bet kādā virzienā tie krīt? Pateicoties universālās gravitācijas likumam, mūsu auglis nokrīt zemē, tas ir, iet uz leju, bet ne uz augšu. Tas bija viens no slavenākajiem fizikas piemēriem, taču pievērsīsim uzmanību termodinamikai, precīzāk, fāzu līdzsvaram, kas mūsu dzīvē ir ne mazāk svarīgi.
Termodinamika

Vispirms apskatīsim šo terminu. ΘερΜοδυναΜική - šādi šis vārds izskatās grieķu valodā. Pirmā daļa ΘερΜo nozīmē "siltums", bet otrā δυναΜική nozīmē "spēks". Termodinamika ir fizikas nozare, kas pēta makroskopiskas sistēmas īpašības, kā arī dažādus enerģijas pārveidošanas un pārneses veidus. Šajā sadaļā īpaši tiek pētīti dažādi stāvokļi un procesi, lai aprakstā varētu ieviest temperatūras jēdzienu (tas ir fizikāls lielums, kas raksturo termodinamisko sistēmu un tiek mērīts, izmantojotnoteiktas ierīces). Visus notiekošos procesus termodinamiskajās sistēmās apraksta tikai ar mikroskopiskiem lielumiem (spiediens un temperatūra, kā arī komponentu koncentrācija).
Klepeirona-Klausiusa vienādojums
Katrs fiziķis zina šo vienādojumu, bet sadalīsim to pa gabalam. Tas attiecas uz līdzsvara procesiem noteiktas vielas pārejā no vienas fāzes uz otru. Tas ir skaidri redzams šādos piemēros: kausēšana, iztvaicēšana, sublimācija (viens no produktu konservēšanas veidiem, kas notiek, pilnībā noņemot mitrumu). Formula skaidri parāda notiekošos procesus:
- n=PV/RT;
- kur T ir vielas temperatūra;
- P-spiediens;
- R-īpašais fāzes pārejas siltums;
- V konkrētā skaļuma maiņa.
Vienādojuma izveides vēsture

Klausiusa-Klepeirona vienādojums ir lielisks matemātisks termodinamikas likuma skaidrojums. To dēvē arī par "Klausiusa nevienlīdzību". Likumsakarīgi, ka teorēmu izstrādāja pats zinātnieks, kurš vēlējās izskaidrot attiecības starp siltuma plūsmu sistēmā un entropiju, kā arī tās vidi. Šo vienādojumu izstrādāja Clausius, mēģinot izskaidrot un kvantitatīvi noteikt entropiju. Burtiskā nozīmē teorēma dod mums iespēju noteikt, vai ciklisks process ir atgriezenisks vai neatgriezenisks. Šī nevienlīdzība piedāvā kvantitatīvu formulu otrā likuma izpratnei.
Zinātnieks bija viens no pirmajiem, kurš izstrādāja entropijas ideju un pat deva toprocesa nosaukums. Tas, kas tagad pazīstams kā Klausiusa teorēma, pirmo reizi tika publicēts 1862. gadā Rūdolfa sestajā darbā Par transformācijas ekvivalences teorēmas izmantošanu iekšdarbiem. Zinātnieks mēģināja parādīt proporcionālu sakarību starp entropiju un enerģijas plūsmu, karsējot (δ Q) sistēmā. Būvniecībā šo siltumenerģiju var pārvērst darbā, un cikliskā procesā to var pārveidot siltumā. Rūdolfs pierādīja, ka "visu cikliskā procesā notiekošo transformāciju algebriskā summa var būt tikai mazāka par nulli vai ārkārtējos gadījumos vienāda ar nulli."
Slēgta izolēta sistēma
Izolēta sistēma ir viena no šīm:
- Fiziskā sistēma ir tālu no citām, kas ar tām nesadarbojas.
- Termodinamisko sistēmu noslēdz stingras, nekustīgas sienas, caur kurām nevar iziet ne matērija, ne enerģija.
Neskatoties uz to, ka objekts ir iekšēji saistīts ar savu gravitāciju, izolēta sistēma parasti tiek pārņemta ārpus ārējo gravitācijas un citu tālu spēku robežām.
To var pretstatīt tam, ko (vispārīgākā terminoloģijā, ko izmanto termodinamikā) sauc par slēgtu sistēmu, ko ieskauj selektīvas sienas, caur kurām var pārnest enerģiju siltuma vai darba veidā, bet ne matēriju. Un ar atvērtu sistēmu, kurā ieplūst vai iziet viela un enerģija, lai gan tajā var būt dažādas necaurejamas sienasdaļu no tās robežām.
Izolēta sistēma ievēro saglabāšanas likumu. Visbiežāk termodinamikā matērija un enerģija tiek uzskatītas par atsevišķiem jēdzieniem.
Termodinamiskās pārejas
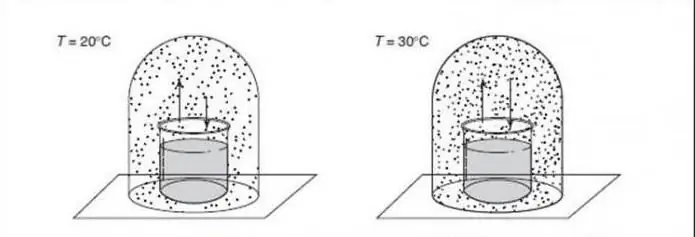
Lai izprastu kvantu fāzu pārejas, ir lietderīgi tās salīdzināt ar klasiskajām transformācijām (sauktas arī par termiskām inversijām). CPT apraksta sistēmas termodinamisko īpašību smaili. Tas norāda uz daļiņu reorganizāciju. Tipisks piemērs ir ūdens sasalšanas pāreja, kas raksturo vienmērīgu pāreju starp šķidrumu un cietu vielu. Klasiskās fāzes pieauguma cēlonis ir konkurence starp sistēmas enerģiju un tās termisko svārstību entropiju.
Klasiskajai sistēmai nulles temperatūrā nav entropijas, tāpēc nevar notikt fāzes transformācija. To secību nosaka pirmais pārtrauktā atvasinājuma termodinamiskais potenciāls. Un, protams, tam ir pirmais pasūtījums. Fāzu transformācijas no feromagnēta uz paramagnētu ir nepārtrauktas un otrās kārtas. Šīs pastāvīgās izmaiņas no sakārtotas uz nesakārtotu fāzi apraksta ar secības parametru, kas ir nulle. Iepriekšminētajai feromagnētiskajai transformācijai secības parametrs būs sistēmas kopējā magnetizācija.
Gibsa potenciāls
The Gibbs Free Energy ir maksimālais darba apjoms bez izplešanās, ko var noņemt no termodinamiskas slēgtas sistēmas (kas var apmainīties ar siltumu un strādāt ar vidi). Tādasmaksimālo rezultātu var iegūt tikai pilnīgi atgriezeniskā procesā. Kad sistēma pārvēršas atpakaļ no pirmā stāvokļa uz otro, Gibsa brīvās enerģijas samazinājums ir vienāds ar to, ko sistēma veic savā vidē, atskaitot spiediena spēku darbu.
Bilances stāvokļi

Termodinamiskais un mehāniskais līdzsvars ir aksiomātisks termodinamikas jēdziens. Tas ir vienas vai vairāku sistēmu iekšējais stāvoklis, ko savieno vairāk vai mazāk caurlaidīgas vai necaurlaidīgas sienas. Šādā stāvoklī nav tīru makroskopisku vielas vai enerģijas plūsmu ne sistēmā, ne starp sistēmām.
Savā iekšējā līdzsvara stāvokļa koncepcijā makroskopiskas izmaiņas nenotiek. Sistēmas vienlaikus atrodas savstarpējā termiskā, mehāniskā, ķīmiskā (konstantā), starojuma līdzsvarā. Tie var būt tādā pašā formā. Šajā procesā visi skati tiek saglabāti uzreiz un uz nenoteiktu laiku, līdz tiek pārtraukta fiziskā darbība. Makroskopiskā līdzsvarā notiek perfekti precīzas līdzsvarotas apmaiņas. Iepriekš minētais pierādījums ir fizisks šī jēdziena skaidrojums.
Pamatinformācija
Katram likumam, teorēmām, formulām ir savi pamati. Apskatīsim 3 fāzu līdzsvara likuma pamatus.
- Fāze ir vielas forma, kas ir viendabīga pēc ķīmiskā sastāva, fizikālā stāvokļa un mehāniskā līdzsvara. Tipiskās fāzes ir cieta, šķidra un gāzveida. Divi nesajaucami šķidrumi (vai šķidri maisījumi ar dažādu sastāvu), kas atdalīti ar atsevišķu robežu, tiek uzskatīti par divām atšķirīgām fāzēm un nesajaucamām cietām vielām.
- Komponentu skaits (C) ir sistēmas ķīmiski neatkarīgo komponentu skaits. Minimālais neatkarīgo sugu skaits, kas nepieciešams, lai noteiktu visu sistēmas fāžu sastāvu.
- Brīvības pakāpju skaits (F) šajā kontekstā ir intensīvo mainīgo skaits, kas ir neatkarīgi viens no otra.
Klasifikācija pēc fāzu līdzsvara
- Nepārtrauktas neto pārneses reakcijas (bieži sauktas par cietvielu reakcijām) notiek starp dažāda sastāva cietām vielām. Tie var ietvert elementus, kas atrodami šķidrumos (H, C), bet šie elementi tiek saglabāti cietās fāzēs, tāpēc šķidrās fāzes netiek izmantotas kā reaģenti vai produkti (H2O, CO2). Tīras cietās vielas pārneses reakcijas var būt nepārtrauktas vai pārtrauktas, vai terminālas.
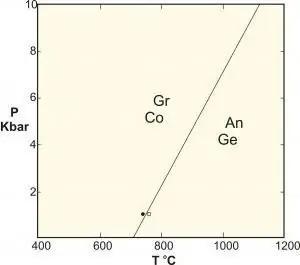
- Polymorphic ir īpašs cietās fāzes reakcijas veids, kas ietver identiska sastāva fāzes. Klasiski piemēri ir reakcijas starp alumīnija silikātiem kianītu-sillimanītu-andalūzītu, grafīta pārvēršanu dimantā augstā spiedienā un kalcija karbonāta līdzsvaru.
Līdzsvara likumi

Gibsa rūpnīcas noteikumu ierosināja Džosija Vilards Gibss savā slavenajā rakstā "Neviendabīgo vielu līdzsvars", kas parādījās no 1875. līdz 1878. gadam. Tas attiecas uznereaģējošas daudzkomponentu heterogēnas sistēmas termodinamiskā līdzsvarā un ir dota vienādība:
- F=C-P+2;
- kur F ir brīvības pakāpju skaits;
- C - komponentu skaits;
- P - fāžu skaits termodinamiskā līdzsvarā savā starpā.
Brīvības pakāpju skaits ir neaizņemto intensīvo mainīgo skaits. Lielākais termodinamisko parametru skaits, piemēram, temperatūra vai spiediens, kas var mainīties vienlaicīgi un patvaļīgi, viens otru neietekmējot. Vienkomponentu sistēmas piemērs ir sistēma ar vienu tīru ķīmisku vielu, savukārt divkomponentu sistēmām, piemēram, ūdens un etanola maisījumiem, ir divi neatkarīgi komponenti. Tipiskas fāzu pārejas (fāzu līdzsvars) ir cietas vielas, šķidrumi, gāzes.
Fāzes noteikums nemainīgā spiedienā
Materiālzinātnē, kas nodarbojas ar fāzu izmaiņām starp dažādām cietām struktūrām, bieži rodas pastāvīgs spiediens (piemēram, viena atmosfēra), un tas tiek ignorēts kā brīvības pakāpe, tāpēc noteikums kļūst: F=C - P + 1.
Šo formulu dažkārt ievada ar nosaukumu "kondensētās fāzes noteikums", taču, kā zināms, tā nav piemērojama šīm sistēmām, kas ir pakļautas augstam spiedienam (piemēram, ģeoloģijā), jo to sekas spiediens var izraisīt katastrofālas sekas.
Var šķist, ka fāzes līdzsvars ir tikai tukša frāze, un ir daži fiziski procesi, kuros šis brīdisir iesaistīta, taču, kā mēs redzējām, bez tā daudzi mums zināmie likumi nedarbojas, tāpēc jums ir nedaudz jāiepazīstas ar šiem unikālajiem, krāsainajiem, kaut arī nedaudz garlaicīgajiem noteikumiem. Šīs zināšanas ir palīdzējušas daudziem cilvēkiem. Viņi iemācījās tos piemērot sev, piemēram, elektriķi, zinot noteikumus darbam ar fāzēm, var pasargāt sevi no nevajadzīgām briesmām.






